2022-04-14 17:37

多潜能干细胞具有无限增殖特性和分化成生物体所有功能细胞类型的能力。北京大学邓宏魁团队经多年努力,成功开发化学小分子诱导技术使人成体细胞逆转为多潜能干细胞。这一由中国自主研发的多潜能干细胞(人CiPS细胞)制备技术,为干细胞和再生医学的发展解决了底层技术上的瓶颈问题。这一突破性研究成果于13日晚在线发表于国际学术期刊《自然》。
2022-04-14 09:22
今日,顶尖学术期刊《自然》上线了一篇来自中国科研团队的重磅研究。北京大学邓宏魁教授领衔的团队,在干细胞领域取得突破性成果,首次在国际上报道使用化学小分子诱导人成体细胞转变为多能干细胞。

2012年,诺贝尔生理学或医学奖授予山中伸弥教授与John B. Gurdon教授两位科学家,表彰他们在多能干细胞诱导上做出的贡献。
多能干细胞具有无限增殖的特性,能够分化为生物体所有功能细胞类型。在人类等哺乳动物的自然发育过程中,多能干细胞只在胚胎发育的早期阶段短暂存在,随后它们会分化为各种类型的成体细胞。而“诱导多能干细胞”(iPSC)却逆转了这一过程。两位诺奖得主的工作发现,利用细胞核移植和导入外源基因的方法,可以诱导成体细胞回到胚胎发育早期状态,被重新编程为具备“多能性”的干细胞。
此次,继“细胞核移植”和“转录因子诱导”之后,中国科学家提出了一种全新的诱导人多能干细胞制备技术:化学重编程。
 ▲领衔此次研究的邓宏魁教授(图片来源:北京大学生命科学学院官网)
▲领衔此次研究的邓宏魁教授(图片来源:北京大学生命科学学院官网)
据邓宏魁教授介绍,这项工作可谓“十年磨一剑”的结晶。2013年,研究团队在《科学》上发表原创成果,首先在小鼠上实现了化学重编程,也就是不依赖卵母细胞和转录因子等细胞内源物质,仅使用外源性化学小分子逆转细胞命运,将小鼠体细胞重编程为多能干细胞(化学重编程诱导多能干细胞,简称CiPS)。
此后,研究团队与多个合作者逐步阐明了化学重编程的独特机制,并对体系做出大幅优化,最终向制备人多能干细胞开发新途径。
 ▲新一代诱导多潜能干细胞技术的发展路程(图片来源:研究作者提供)
▲新一代诱导多潜能干细胞技术的发展路程(图片来源:研究作者提供)
相比传统方法,化学小分子的优势包括操作简便,时空调控性强,作用可逆,细胞重编程过程高度可控。另外小分子诱导体细胞重编程技术规避了传统转基因操作引发的安全问题,有望成为更安全的临床治疗手段。
然而,化学重编程诱导人多能干细胞仍有重重挑战。由于人类成体细胞具有更稳定的表观遗传,细胞命运的可塑性更低,更难通过化学小分子的刺激获得多潜能的特性。有趣的是,研究人员受到蝾螈肢体再生的启发,通过创建一个关键的中间步骤实现了突破。
蝾螈等两栖动物有堪称神奇的断肢再生术,受到外界损伤后,体细胞会自发改变本身的特性,进而通过去分化获得一定的可塑性,借助这一可塑的中间状态实现肢体的再生。
沿着这一思路,研究团队进行了大量化学小分子的筛选和组合,最终发现高度分化的人成体细胞在特定的化学小分子组合的作用下,可以发生类似去分化的现象,获得具有一定可塑性的中间状态。研究团队确认,人CiPS细胞诱导的早期阶段激活了与动物断肢再生早期类似的基因表达特征。
 ▲通过创建一个可塑性中间状态,实现人体细胞化学重编程诱导人CiPS细胞(图片来源:参考资料[1])
▲通过创建一个可塑性中间状态,实现人体细胞化学重编程诱导人CiPS细胞(图片来源:参考资料[1])
该研究还进一步描述了化学重编程诱导人CiPS细胞的独特分子机制。人CiPS的诱导以分阶段精确调控的方式发生,其中JNK通路是化学重编程的主要障碍,因此抑制JNK通路对于通过抑制促炎症通路来诱导细胞可塑性、重新获得类似再生的中间状态至关重要。
“这一再生中间态为研究人体细胞重新激活再生基因提供了全新的思路,并且提示,有望推动化学重编程在组织器官再生方向的应用,为再生医学研究提供新的可能途径。”研究人员指出。
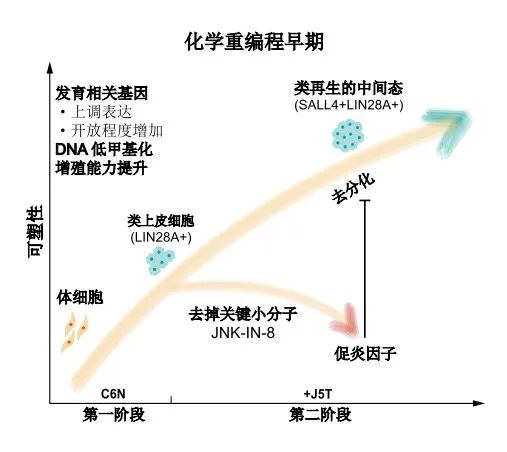 ▲化学重编程激活再生相关网络的分子机制(图片来源:研究作者提供)
▲化学重编程激活再生相关网络的分子机制(图片来源:研究作者提供)
近年来,诱导多能干细胞技术的建立,在细胞治疗、药物筛选和疾病模型等领域产生了广泛的应用价值,尤其是为患者构建自体特异性干细胞系,大大加速了干细胞临床应用的进程。基于原有的iPSC技术,目前已有针对帕金森病、糖尿病和癌症等多种重点疾病的细胞治疗临床试验开展起来。
邓宏魁教授评论说,现在我们有了原创的新一代人多能干细胞制备技术,不仅有助于更好地理解细胞命运决定和转变机制,而且为未来再生医学治疗重大疾病带来新的可能。
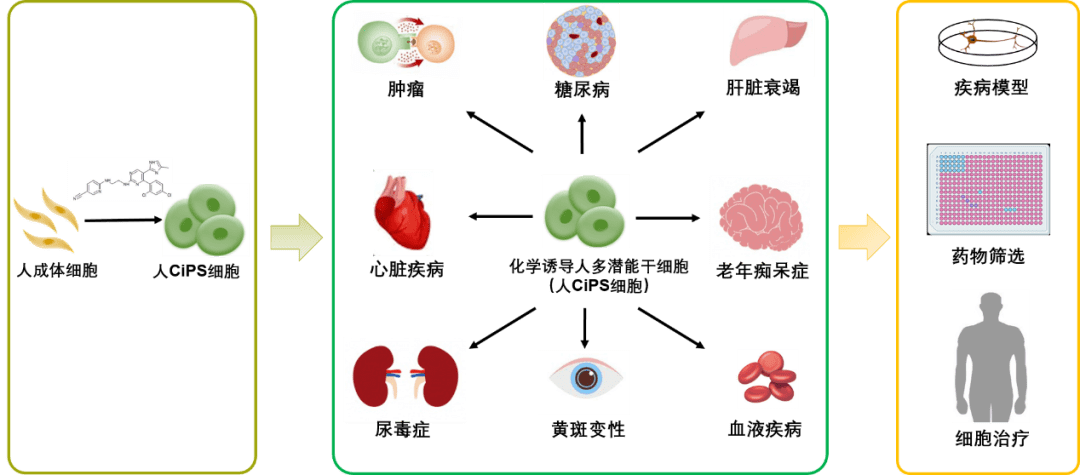 ▲人CiPS技术在生物医学领域具备广阔的应用前景(图片来源:研究作者提供)
▲人CiPS技术在生物医学领域具备广阔的应用前景(图片来源:研究作者提供)
北京大学生命科学学院、北大-清华生命联合中心邓宏魁教授领导了此项研究。邓宏魁教授,北京大学王金琳博士和中国人民解放军总医院卢实春教授是这一研究成果的共同通讯作者。北京大学关景洋,王冠,王金琳,张正元,傅瑶,成林,孟高帆,吕钰麟为该研究成果的主要作者。北京大学李程教授为该研究的生物信息分析提供了重要指导。本工作获得了北大-清华生命科学联合中心、国家重点研发计划项目、国家自然科学基金等支持。
参考资料:
[1] Jingyang Guan et al., (2022) Chemical reprogramming of human somatic cells to pluripotent stem cells. Nature. https://doi.org/10.1038/s41586-022-04593-5
